Perguntas frequentes
1. A MVO Portugal
1.1. Quem são os membros da MVO Portugal?
A MVO Portugal foi constituída em 4 de Agosto de 2017 pelas seguintes entidades:
- APIFARMA – Associação Portuguesa da Indústria Farmacêutica;
- APOGEN – Associação Portuguesa de Medicamentos Genéricos e Biossimilares;
- APIEM – Associação Portuguesa de Importadores e Exportadores de Medicamentos;
- ADIFA – Associação de Distribuidores Farmacêuticos;
- GROQUIFAR – Associação de Grossistas de Produtos Químicos e Farmacêuticos;
- AFP – Associação de Farmácias de Portugal;
- ANF – Associação Nacional de Farmácias.
1.2. Quais são as responsabilidades da MVO Portugal?
A MVO Portugal é a entidade responsável pela implementação e operação do sistema nacional de verificação de medicamentos, no seguimento do estabelecido pela Diretiva n.º 2001/83/CE, do Parlamento Europeu e do Conselho de 6 de Novembro de 2001, alterada pela Diretiva n.º 2011/62/EU, do Parlamento Europeu e do Conselho, de 8 de Junho de 2011 e pelo Regulamento Delegado (EU) n.º 2016/161, da Comissão de 2 de Outubro de 2015. No seguimento da publicação do Regulamento Delegado, foi publicado o Decreto-Lei nº26/2018, de 24 de Abril, transpondo para o ordenamento jurídico nacional o disposto na legislação europeia.Mais especificamente, são responsabilidades da MVO Portugal (Artigo 4º dos Estatutos):
-
Aplicar os requisitos definidos pela EMVO e assegurar a qualidade geral no funcionamento do Sistema, nomeadamente a limpeza de dados, a disponibilidade e a capacidade de resposta do Sistema e o nível apropriado de segurança;
-
Definir os termos e as condições de acesso ao Sistema, que devem ser objetivos e transparentes;
-
Definir e implementar os requisitos e os procedimentos necessários ao regular funcionamento do Sistema, incluindo a identificação e resolução de quaisquer irregularidades;
-
Contratar um ou mais prestadores credenciados de Serviços de Tecnologia de Informação e Comunicação (adiante designados por “Serviços TIC”) para instalar e gerir o Sistema;
-
Contratar os colaboradores e fornecedores necessários para a prossecução do seu objeto;
-
Elaborar e gerir os acordos de utilização do Sistema e definir disposições relativas a remunerações e modalidades de pagamento, tendo em conta o estabelecido no artigo 31.º do Regulamento Delegado e o acordado entre os Membros Efetivos;
-
Garantir a comunicação com as autoridades reguladoras nacionais sobre a utilização do Sistema para facilitar os procedimentos de recolha de medicamentos e gerir outras questões relacionadas com a segurança dos doentes;
-
Elaborar e fornecer aos membros e ao Conselho Consultivo relatórios regulares de atividade e relatórios estatísticos sobre o funcionamento e o desempenho do Sistema;
-
Realizar periodicamente avaliações estratégicas ao Sistema para garantir que este evolui ao longo do tempo, no interesse da segurança dos doentes e em linha com a evolução da infraestrutura dos cuidados de saúde em Portugal e na Europa;
-
Faturar e cobrar as quotas, taxas e demais custos de participação, nos termos da Diretiva e do Regulamento Delegado, e quaisquer outras quantias devidas pelos membros nos termos estatutários.
1.3. A MVO Portugal pode realizar algum tipo de atividade comercial?
Não. Está vedado à MVO Portugal o exercício de qualquer atividade comercial.
1.4. A MVO Portugal é uma nova autoridade do medicamento?
Não. A MVO Portugal não tem qualquer responsabilidade ou intervenção nos domínios inspetivo, sancionatório ou outros que sejam do domínio da atividade do INFARMED, I.P.
1.5. Como é a financiada a atividade da MVO Portugal?
A atividade da MVO Portugal é financiada através dos montantes pagos pelos Titulares de AIM/AIP e pelos seus Membros (APIFARMA, APOGEN, APIEM, ADIFA, GROQUIFAR, AFP e ANF), de acordo com o modelo aprovado em Assembleia-Geral.
2. Dispositivos de segurança
2.1. O que são dispositivos de segurança?
Dispositivos de segurança são os elementos a incluir nas embalagens dos medicamentos abrangidos pela Diretiva e pelo Regulamento Delegado, que em conjunto permitirão verificar a autenticidade de um medicamento num sistema de verificação de extremo a extremo.
Os dispositivos de segurança a colocar nas embalagens são o identificador único e o dispositivo de prevenção de adulterações. A verificação da autenticidade do identificador único destina-se a garantir que o medicamento é proveniente do fabricante legítimo. A verificação da integridade do dispositivo de prevenção de adulterações revela se a embalagem foi aberta ou alterada desde que saiu das instalações do fabricante, assegurando assim que o conteúdo da embalagem é autêntico.
2.2. O que é o identificador único?
O identificador único consiste no dispositivo de segurança que permite a verificação da autenticidade e a identificação de uma embalagem individual de um medicamento.
2.2.1. Como é composto o identificador único para uma embalagem a circular em Portugal?
O identificador único é composto pelos seguintes elementos:
- Código do produto (GTIN);
- Número de série;
- Lote;
- Data de validade;
- Número de registo.
Os elementos acima serão codificados num código de barras bidimensional DataMatrix (standard GS1).Os cinco elementos mencionados acima deverão ser impressos na embalagem. Não existe uma ordem pré-definida para impressão dos elementos, e estes podem ser colocados em qualquer face da embalagem embora seja desejável que, sempre que possível, figurem na mesma face do código DataMatrix.Mais informação pode ser encontrada aqui.
2.2.2. Como é composto o identificador único para uma embalagem a circular em Portugal e Espanha?
O identificador único deverá conter os seguintes elementos:
- Código do produto (GTIN);
- Número de série;
- Lote;
- Data de validade;
- Número de registo nacional – Portugal;
- Número de registo nacional – Espanha.
Da mesma forma, os seis elementos mencionados acima deverão ser impressos na embalagem. Não existe uma ordem pré-definida para impressão dos elementos, e estes podem ser colocados em qualquer face da embalagem embora seja desejável que, sempre que possível, figurem na mesma face do código DataMatrix. O código nacional Espanhol deverá figurar no canto superior direito, conforme é exigido atualmente.Note-se que em Espanha é possível utilizar GTIN e NTIN. No caso de embalagens a circular em Espanha e Portugal, deverá ser sempre utilizado GTIN e não NTIN.
2.3. Qual a informação a ser legível por pessoas na embalagem do medicamento?
No artigo 7º do Regulamento Delegado são estabelecidos os elementos a colocar na embalagem em formato legível por pessoas. Além disso, deverão constar os elementos previstos pela legislação nacional relativa à rotulagem, nomeadamente a prevista no artigo 105.º do Decreto‐Lei n.º 176/2006, de 30 de agosto, na sua redação atual, a qual continuará a aplicar‐se sem quaisquer alterações.
2.4. O que é o dispositivo de prevenção de adulterações?
O dispositivo de prevenção de adulterações consiste no dispositivo de segurança que permite verificar se a embalagem de um medicamento foi adulterada.
2.5. Quais as especificações a que deve obedecer o dispositivo de prevenção de adulterações?
Não foram definidas na Diretiva nem no Regulamento Delegado especificações técnicas para o dispositivo de prevenção de adulterações. Entende-se que as decisões sobre especificações estão a cargo dos fabricantes. Mais informação pode ser encontrada no documento Safety Features for Medicinal Products for Human Use - Questions And Answers - Version 11;
2.6. Quais são os medicamentos que deverão ser dotados de dispositivos de segurança?
De acordo com a Artigo nº54º-A da Diretiva 2001/83/CE, alterado pela Diretiva 2011/62/EU, devem ser dotados de dispositivos de segurança os medicamentos sujeitos a receita médica.No Anexo I do Regulamento Delegado consta a lista de medicamentos sujeitos a receita médica que não devem ser dotados dos dispositivos de segurança:
|
Nome da substância ativa ou categoria de medicamentos |
Forma farmacêutica |
Dosagem |
|
Medicamentos homeopáticos |
Qualquer |
Qualquer |
|
Geradores de radionuclídeos |
Qualquer |
Qualquer |
|
Kits |
Qualquer |
Qualquer |
|
Precursores de radionuclídeos |
Qualquer |
Qualquer |
|
Medicamentos de terapia avançada que contêm ou consistem em tecidos ou células |
Qualquer |
Qualquer |
|
Gases medicinais |
Gás medicinal |
Qualquer |
|
Soluções para alimentação parenteral com um código ATC (Anatomical Therapeutical Chemical) que começa por B05BA |
Solução para perfusão |
Qualquer |
|
Soluções que afetam o equilíbrio dos eletrólitos com um código ATC que começa por B05BB |
Solução para perfusão |
Qualquer |
|
Soluções que produzem diurese osmótica com um código ATC que começa por B05BC |
Solução para perfusão |
Qualquer |
|
Aditivos de soluções intravenosas com um código ATC que começa por B05X |
Qualquer |
Qualquer |
|
Solventes e agentes de diluição, incluindo soluções de irrigação, com um código ATC que começa por V07AB |
Qualquer |
Qualquer |
|
Meios de contraste com um código ATC que começa por V08 |
Qualquer |
Qualquer |
|
Testes para doenças alérgicas com um código ATC que co meça por V04CL |
Qualquer |
Qualquer |
|
Extratos de alergénios com um código ATC que começa por V01AA |
Qualquer |
Qualquer |
No Anexo II do Regulamento Delegado consta a lista de medicamentos não sujeitos a receita médica que devem ser dotados dos dispositivos de segurança:
|
Nome da substância ativa ou categoria de medicamentos |
Forma farmacêutica |
Dosagem |
|
Omeprazole |
Cápsula gastro-resistente, dura |
20 mg |
|
Omeprazole |
Cápsula gastro-resistente, dura |
40 mg |
Adicionalmente, de acordo com o número 2 do artigo 105º-A do Decreto-Lei 26/2018, de 24 de Abril, devem ser dotados de dispositivos de segurança os medicamentos não sujeitos a receita médica que sejam comparticipados. Incluem-se nesta categoria os medicamentos não sujeitos a receita médica de dispensa exclusiva em farmácia (MNSRM-EF), conforme referido no ponto 2 do documento Dispositivos de Segurança – FAQ preparado pelo INFARMED, I.P.
3. O sistema europeu de verificação de medicamentos
3.1. O que é o sistema europeu de verificação de medicamentos?
O sistema de verificação de medicamentos é um sistema pan-europeu, através do qual se pretende evitar a entrada de medicamentos falsificados no circuito de abastecimento legal, bem como detetar potenciais falsificações.
O sistema é composto por um encaminhador central de dados e informações (designado no Regulamento Delegado por “plataforma” e no contexto do projeto por “hub europeu”), e por repositórios que servem os territórios de cada Estado-Membro (designados no Regulamento Delegado por “repositórios nacionais” e no contexto do projeto por “sistemas nacionais”). O âmbito territorial do sistema europeu de verificação de medicamentos é o Espaço Económico Europeu, composto pelos países pertencentes à União Europeia, mais Islândia, Liechtenstein, Noruega e Suíça.
3.2. Quem gere o sistema europeu de verificação de medicamentos?
O hub europeu é gerido pela European Medicines Verification Organization (EMVO), e cada sistema nacional é gerido pela organização nacional responsável. Em cada um dos países âmbito do projeto foi estabelecida uma organização congénere da MVO Portugal. Os contactos das várias National Medicines Verification Organization (NMVO) podem ser encontrados aqui.
3.3. Acesso ao hub europeu
O hub europeu consiste no único ponto de entrada de dados em todo o sistema europeu de verificação de medicamentos. É através do hub europeu que os onboarding partners (OBP) inserem os dados relativos às embalagens que irão ser libertadas para o mercado. Apenas os onboarding partners poderão carregar dados no hub europeu.O processo de acesso ao hub europeu é designado por onboarding. Mais informação sobre o processo de onboarding junto da EMVO pode ser encontrada aqui.
3.4. O que é um onboarding partner?
O onboarding partner (OBP) é a entidade legal que irá estabelecer contrato com a EMVO para efetuar o carregamento dos dados no hub europeu. Esta entidade legal atuará em representação das empresas do grupo empresarial a que pertença. A título de exemplo: no grupo multinacional XPTO que atua nos 32 países âmbito do projeto, a entidade legal XYZ será o onboarding partner perante a EMVO e irá efetuar o carregamento dos dados relativos às embalagens que irão circular nos 32 países. Os países não necessitam de estabelecer conexão ao hub europeu de forma individualizada.
3.5. As contract manufacturer organizations (CMO) podem conectar-se diretamente ao sistema europeu?
Não. Apenas Titulares de AIM e ou Titulares de AIP poderão ter contrato com a EMVO para carregamento dos dados, pois apenas estes são responsáveis pelos produtos. O mesmo se aplica aos third party logistics (3PL). Mais informação poderá ser encontrada aqui.
3.6. A partir de quando podem os OBP efetuar carregamento de dados para Portugal?
O sistema nacional de verificação de medicamentos encontra-se operacional e em produção, estando já conectado ao ambiente de produção do hub europeu. Assim, os OBP poderão efetuar desde já o carregamento dos dados no ambiente de produção via hub europeu.
3.7. É obrigatório o carregamento de dados para o repositório nacional, quando este se encontrar operacional mas antes da entrada em vigor do Regulamento Delegado?
Não. Contudo, é recomendável que seja realizado o carregamento dos dados relativos aos identificadores únicos dos medicamentos libertados para venda ou distribuição antes da data de entrada em vigor do Regulamento Delegado, para que possam ser evitados alertas após a entrada em vigor do Regulamento Delegado, por inexistência de informação no sistema.
3.8. Qual a data de entrada em vigor?
O Regulamento Delegado entrará em vigor no dia 9 de fevereiro de 2019. Assim, todos os trabalhos preparatórios deverão ser concluídos até essa data.
4. O sistema nacional de verificação de medicamentos
4.1. O que é o sistema nacional de verificação de medicamentos?
O sistema nacional de verificação de medicamentos é parte integrante do sistema europeu de verificação de medicamentos e consiste no repositório nacional, no qual residirá a informação relativa às embalagens em circulação no território Português. Os utilizadores do sistema nacional (distribuidores, farmácias e estabelecimentos de cuidados de saúde) irão estabelecer conexão com este para que possam executar as operações de verificação e desativação do identificador único a que estão obrigados.
4.2. O sistema nacional de verificação de medicamentos foi concebido para outras operações além da verificação e desativação de identificadores únicos?
Não. O sistema foi concebido para obviar a verificação e desativação dos identificadores únicos, não sendo substituto de operações já existentes nas organizações dos utilizadores. O sistema não foi concebido, a título de exemplo, para gestão de stocks, gestão financeira, e outros processos.
4.3. Como funciona o sistema?
Esquematicamente e de forma sucinta, o sistema funcionará da seguinte forma: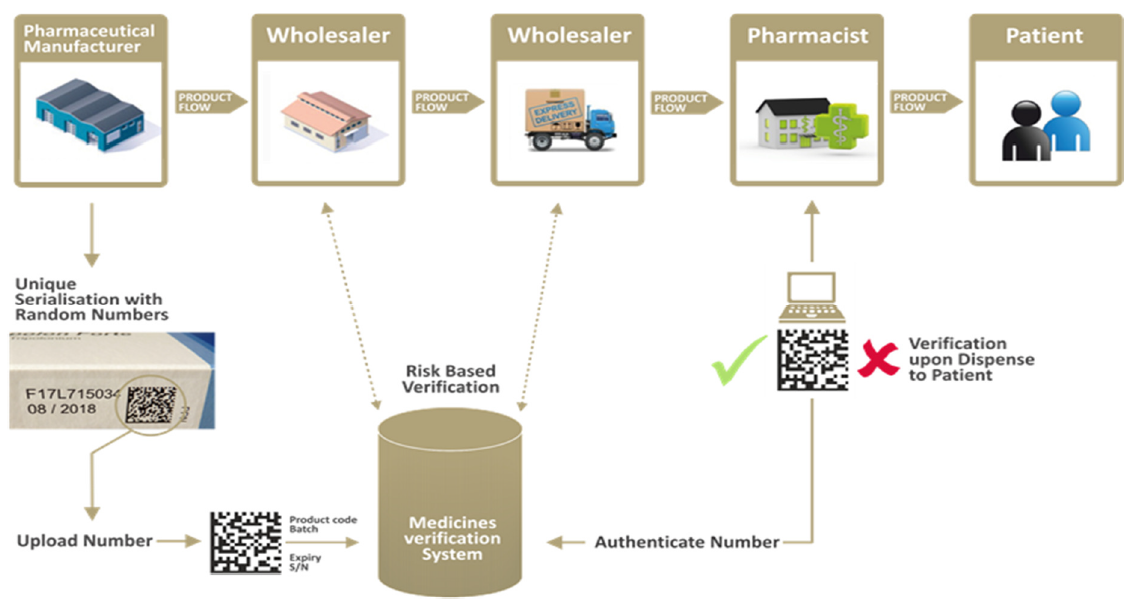
Fonte: EMVO.
A verificação da autenticidade do medicamento é realizada através da comparação entre a informação relativa ao identificador único registada pelo OBP, e a informação relativa ao identificador único que consta na embalagem.
Os dados relativos a cada embalagem serão carregados no sistema pelo onboarding partner (entidade responsável pelo carregamento de dados perante a EMVO) através do hub europeu. Por sua vez, de forma automatizada o hub europeu encaminhará os dados para os sistemas nacionais relevantes, onde ficarão residentes. Os utilizadores (distribuidores, farmácias e estabelecimentos de cuidados de saúde), através da conexão estabelecida para o efeito irão executar a leitura do identificador único que consta na embalagem, de modo a que esta seja comparada com a informação que consta no repositório nacional.
A verificação do dispositivo de prevenção de adulterações é realizada através de inspecção visual, e assim sem recurso ao sistema.
4.4. Uma determinada embalagem será verificada em todos os pontos da cadeia de abastecimento por onde passe?
Não necessariamente, pois o sistema não foi concebido numa lógica track & trace. O sistema foi concebido numa lógica de risco, significando que há pontos na cadeia de abastecimento em que a verificação não é obrigatória por considerar-se que o risco de falsificação é negligenciável.
Na alínea b) do artigo 20º do Regulamento Delegado é referido que o grossista (para os efeitos deste documento grossista e distribuidor são sinónimos) deve verificar os “medicamentos que recebe de um grossista que não é nem o fabricante nem o grossista titular da autorização de introdução no mercado, nem um grossista designado pelo titular da autorização de introdução no mercado, através de um contrato escrito, para armazenar e distribuir em seu nome os medicamentos abrangidos pela sua autorização de introdução no mercado”. Tal significa que não é exigida ao Distribuidor a verificação dos medicamentos recebidos do fabricante, do grossista titular da autorização de introdução no mercado, ou de um grossista designado pelo titular da autorização de introdução no mercado, através de um contrato escrito, para armazenar e distribuir em seu nome os medicamentos abrangidos pela sua autorização de introdução no mercado.
Note-se que as entidades nos extremos da cadeia de abastecimento legal (onboarding partners por um lado, e pessoas autorizadas ou habilitadas a fornecer medicamentos ao público, por outro) estão sempre obrigadas à execução das operações definidas na Diretiva e no Regulamento Delegado, não se aplicando a lógica de verificação com base em risco.
4.5. Existe obrigação de verificação das embalagens na logística inversa?
Sim. Conforme referido na alínea b) do artigo 22º do Regulamento Delegado, devem os grossistas verificar a autenticidade dos “medicamentos que lhe tenham sido devolvidos por pessoas autorizadas ou habilitadas a fornecer medicamentos ao público ou por outro grossista e que não podem ser restituídos às existências comerciáveis”.
Note-se que no Regulamento Delegado não é feita referência ao motivo de devolução. Assim, e a título de exemplo, embalagens devolvidas para destruição por ter sido atingido o prazo de validade devem ser verificadas.
4.6. Quem tem acesso a que dados no sistema?
De acordo com o artigo 38º do Regulamento Delegado, “os fabricantes, os titulares de autorizações de introdução no mercado, os grossistas e as pessoas autorizadas ou habilitadas a fornecer medicamentos ao público são responsáveis por todos os dados gerados quando interagem com o sistema de repositórios e armazenados na pista de auditoria. Só são proprietários e só podem ter acesso a esses mesmos dados, com exceção das informações referidas no artigo 33º, nº2, e das informações sobre o estado dos identificadores únicos”.
A MVO Portugal não pode ter acesso à pista de auditoria e aos dados nela contidos sem o acordo escrito dos legítimos proprietários dos dados, exceto para efeitos de investigação de incidentes potenciais de falsificação assinalados no sistema em conformidade com o artigo 36º, alínea b) do Regulamento Delegado.
O INFARMED, I.P. terá acesso ao sistema nacional de verificação de medicamentos, enquanto Autoridade Nacional do Medicamento, para os seguintes fins:
-
supervisão do funcionamento dos repositórios e investigação de eventuais casos de falsificação;
-
reembolsos;
-
farmacovigilância ou farmacoepidemiologia.
4.7. O que é a pista de auditoria?
De acordo com a alínea g) do artigo 35º do Regulamento Delegado, a pista de auditoria consiste no registo completo de todas as operações relacionadas com um identificador único, dos utilizadores que efetuam essas operações e da natureza das operações. A pista de auditoria deve ser criada quando o identificador único é carregado no repositório e ser conservada durante, pelo menos, um ano após o termo do prazo de validade do medicamento dotado do identificador único ou cinco anos depois de o medicamento ter sido libertado para venda ou distribuição em conformidade com o artigo 51º, nº3, da Diretiva 2001/83/CE, conforme o período que for mais alargado.
4.8. O que acontece quando os dados do identificador único não coincidirem com os dados registados no repositório?
Para uma determinada embalagem, quando os dados do identificador único não coincidirem com dados registados no repositório o sistema irá desencadear um alerta de potencial falsificação (cf. a alínea b) do artigo 36º do Regulamento Delegado).
4.9. O que fazer em caso de alerta de potencial falsificação?
De acordo com o ponto 29 do documento Dispositivos de Segurança – FAQ preparado pelo INFARMED, I.P., pode ser lido que “no caso de o sistema dar alerta de estar perante um medicamento falsificado ou roubado, deverão as entidades segregar o produto, identificando-o, e informar o Infarmed e o Titular de AIM do medicamento”.Os aspetos informáticos, processuais e de comunicação estão ainda em discussão a nível europeu, com o objetivo de obter a maior harmonização possível entre países, sem prejuízo das especificidades nacionais.
4.10. Como devem ser tratados os alertas ocorridos antes de 9 de Fevereiro de 2019?
Segundo a interpretação do INFARMED, I.P., os alertas gerados pelo sistema antes de 9 de Fevereiro de 2019 não têm validade legal dado que ocorrerão antes da entrada em vigor do Regulamento Delegado. Os alertas que surjam antes da entrada em vigor do Regulamento Delegado não darão origem a nenhum processo formal.
4.11. Existem diferenças na implementação do sistema ou do seu funcionamento nas Regiões Autónomas?
Não. Todas as regras estabelecidas são aplicáveis integralmente às entidades sedeadas ou a operar nas Regiões Autónomas.
4.12. Qual a relação entre os processos financeiros e as operações de verificação e desativação?
As operações de verificação e desativação de identificadores únicos são independentes dos processos financeiros associados aos medicamentos em causa.
4.13. Vai ser implementada agregação de identificadores únicos?
O Regulamento Delegado não proíbe nem obriga a implementação de soluções de agregação. Estão em curso discussões a nível europeu acerca de possíveis cenários de implementação de soluções de agregação, designadamente no contexto dos estabelecimentos de cuidados de saúde. Não foram até à data tomadas decisões finais e vinculativas em relação à implementação de soluções de agregação no contexto do sistema europeu de verificação de medicamentos.
5. Acesso ao sistema nacional de verificação de medicamentos
5.1. Quem está obrigado a conectar-se ao sistema nacional de verificação de medicamentos?
Estão obrigadas a conectar-se ao sistema nacional de verificação de medicamentos as seguintes entidades que exerçam a sua atividade no território nacional:
- Distribuidores: titulares de autorização de distribuição por grosso válida, emitida pelo INFARMED, I.P. ou pela entidade competente nas Regiões Autónomas;
- Farmácias comunitárias: titulares de alvará válido, emitido pelo INFARMED, I.P. ou pela entidade competente nas Regiões Autónomas;
- Estabelecimentos de cuidados de saúde: titulares de aquisição direta de medicamentos emitida pelo INFARMED, I.P. ou pela entidade competente nas Regiões Autónomas, dotados de regime de internamento ou ambulatório. Mais informação pode ser encontrada no ponto 21 do documento Dispositivos de Segurança – FAQ, preparado pelo INFARMED, I.P.
5.2. Será permitida a partilha de credenciais de acesso?
Não. As credenciais de acesso ao sistema nacional de verificação de medicamentos são concedidas pela MVO Portugal a cada entidade após conclusão com sucesso do processo de validação (designado por processo de onboarding). As credenciais de acesso são intransmissíveis e cada utilizador executará as suas atividades no sistema utilizando as credenciais que lhe tenham sido concedidas pela MVO Portugal. A título de exemplo, um distribuidor executará todas as suas atividades com as credenciais de acesso que lhe tenham sido concedidas pela MVO Portugal, independentemente das atividades que execute no sistema ou do proprietário dos medicamentos que tenha na sua posse.
5.3. Quais as consequências para uma entidade que não se conecte ao sistema?
Uma empresa que deva executar verificações e desativações de identificadores únicos e não esteja conectada ao sistema nacional de verificação de medicamentos, estará impossibilitada de cumprir as suas obrigações legais nesse domínio. As sanções aplicáveis serão definidas e executadas pelas autoridades competentes.
Cada entidade é responsável por garantir a necessária preparação para acesso ao sistema nacional de medicamentos.
5.4. Quais os estabelecimentos de cuidados de saúde que deverão conectar-se ao sistema nacional de verificação de medicamentos?
De acordo com o disposto no número 9 do artigo 105º-A do Decreto-Lei nº26/2018, de 24 de Abril, estão obrigados estabelecimentos e serviços detentores de autorização de aquisição direta de medicamentos emitida pelo INFARMED, I. P., que estejam integrados em estabelecimentos de cuidados de saúde, públicos ou privados, que disponham de serviços médicos e farmacêuticos e regime de internamento. Para mais informação, consultar a resposta à questão 21 do documento Dispositivos de Segurança – FAQ, preparado pelo INFARMED, I.P.
5.5. Quais as entidades que não estão obrigadas a conectar-se ao sistema nacional de verificação de medicamentos?
Não estão obrigadas a conectar-se ao sistema nacional de verificação de medicamentos as entidades referidas no artigo 23º do Regulamento Delegado, bem como as entidades referidas no número 9 do artigo 105º-A do Decreto-Lei 26/2018, de 24 de Abril.
Deve ser consultada a lista de estabelecimentos de cuidados de saúde obrigados a proceder à verificação e desactivação de identificadores únicos, preparada pelo INFARMED, I.P.. A lista pode ser consultada aqui.
5.6. Os titulares de AIM/AIP têm acesso ao sistema nacional de verificação de medicamentos?
Não. Os titulares de autorizações de introdução no mercado ou de autorizações de importação paralela realizarão as operações no sistema via hub europeu.
Os titulares de autorizações de introdução no mercado ou de autorizações de importação paralela que sejam titulares de autorização de distribuição por grosso de medicamentos de uso humano emitida pelo INFARMED, I.P. e operem a distribuição dos seus medicamentos ou de medicamentos por si representados devem conectar-se ao sistema nacional de verificação de medicamentos. Para este efeito serão considerados distribuidores e deverão seguir o processo de onboarding definido.
5.7. Qual é o processo de validação para acesso ao sistema nacional de verificação de medicamentos?
Para cumprimento das obrigações decorrentes da legislação, designadamente no que diz respeito à verificação e desativação das embalagens na sua posse, os distribuidores, farmácias e estabelecimentos de cuidados de saúde deverão conectar os seus sistemas de informação com o sistema nacional de verificação de medicamentos.
Para que um determinado utilizador possa aceder ao sistema nacional de verificação de medicamentos, deverá ser concluído com sucesso o processo de validação de acesso. Este processo é designado por processo de onboarding e tem como objetivos a validação da legitimidade do acesso ao sistema, a validação técnica e a assinatura do contrato que regulará a relação entre cada entidade e a MVO Portugal.As decisões relativas ao cenário de integração técnica (e.g. software a utilizar, fornecimento externo vs desenvolvimento interno, etc.) são de cada entidade. De igual modo, as decisões relativas a organização e processos internos são da responsabilidade exclusiva de cada entidade.
- O processo de onboarding para distribuidores pode ser consultado aqui.
- O processo de onboarding para farmácias pode ser encontrado aqui.
- O processo de onboarding para estabelecimentos de cuidados de saúde pode ser consultado aqui.
5.8. Quem deve assegurar o processo de onboarding?
No que diz respeito aos distribuidores e aos estabelecimentos de cuidados de saúde, cada entidade é responsável por assegurar que o processo de onboarding é concluído com sucesso. No que diz respeito às farmácias comunitárias, o processo será assegurado pelas Associações de Farmácias (AFP e ANF). No caso das farmácias que não sejam associadas de AFP nem de ANF, poderão optar pela conexão ao sistema nacional através de uma das Associações, ou por conexão direta ao sistema nacional. Para mais informação, poderá contactar-se a AFP através da página www.afp.com.pt, a ANF através da página www.anf.pt, ou a MVO Portugal através do endereço de email mvo.portugal@mvoportugal.pt.
5.9. O que é a fase piloto e como está estruturada?
A fase piloto consiste num período de testes, cujo objetivo principal é utilizar o sistema em condições o mais próximas possível das condições reais, em que o sistema será utilizado após a entrada em vigor do Regulamento Delegado. Para a execução deste conjunto de testes é necessária a participação de titulares de AIM/AIP, distribuidores, farmácias e estabelecimentos de cuidados de saúde, de modo a que cada um execute as tarefas de verificação e desativação de identificadores únicos que irá executar no dia-a-dia, e seja possível verificar o fluxo de embalagens desde o fabricante até ao ponto de dispensa.Destacam-se os seguintes aspetos:
- A participação na fase piloto é voluntária. Não existe qualquer obrigatoriedade de participação nem qualquer penalização por não participação;
- O foco dos testes a realizar será na capacidade de interação entre sistemas. Os aspetos relacionados com organização e processos internos são da responsabilidade exclusiva de cada participante não serão verificados pela MVO Portugal;
- Diferentes participantes poderão estar em condições de participar em momentos diferentes. Assim, pretende-se o máximo de flexibilidade: a data de entrada na fase piloto é decidida pelo próprio participante, e cada participante poderá executar os testes sem depender de outros participantes;
- A execução dos testes é previamente planeada com a MVO Portugal;
- Os cenários de teste a executar são definidos pela MVO Portugal e orientados a cada tipo de participante (Titular de AIM/AIP, Distribuidor, Farmácia, Estabelecimento de Cuidados de Saúde). Os participantes poderão adicionar outros cenários de teste que considerem relevantes. Cenários de teste adicionais não serão acompanhados pela MVO Portugal.
- Para execução de testes no ambiente de tetes (IQE), os Titulares de AIM/AIP utilizarão os próprios dados e os restantes participantes utilizarão dados fornecidos pela MVO Portugal ou por Titulares de AIM/AIP;
- Considera-se que todas as operações realizadas no ambiente de produção (PRD) são transações reais, pelo que a monitorização da atividade dependerá do estabelecimento da conexão dos diversos participantes ao sistema.
Os participantes na fase piloto deverão documentar os resultados dos testes efetuados utilizando o formulário a disponibilizar para o efeito. Esta informação é necessária para a atribuição das credenciais de acesso ao ambiente de produção.
6. Período de transição
6.1. Está previsto um período de transição?
Sim. De acordo com o artigo 48º do Regulamento Delegado, “os medicamentos que tenham sido libertados para venda ou distribuição sem os dispositivos de segurança num Estado-Membro antes da data de aplicação do presente regulamento no referido Estado-Membro, e não tenham sido posteriormente reembalados ou novamente rotulados, podem ser colocados no mercado, distribuídos e fornecidos ao público nesse Estado-Membro até ao respetivo prazo de validade”.
6.2. É possível a coexistência de embalagens no mercado com o código de barras 39 e o código datamatrix?
Sim, desde que o código de barras 39 não tenha impacto na legibilidade da embalagem exterior.
6.3. A remoção do código de barras 39 é obrigatória em lotes libertados a partir de 9 de fevereiro de 2019?
Não. Para mais informação, consultar a resposta à questão 18 do documento Dispositivos de Segurança – FAQ, preparado pelo INFARMED, I.P.
7. Onde é possível encontrar mais informação?
Pode ser encontrada mais informação nos seguintes documentos:
-
Regulamento Delegado (EU) n.º 2016/161, da Comissão de 2 de Outubro de 2015;
-
Safety Features for Medicinal Products for Human Use - Questions And Answers - Version 12;
-
Nota Informativa conjunta INFARMED, I.P., ACSS, I.P. e SPMS, E.P.E. (específico SNS);
-
Circular Normativa Conjunta n.º 01/ACSS/INFARMED/SPMS (específico SNS).
Caso não tenha encontrado resposta para a sua questão, envie a sua questão para mvo.portugal@mvoportugal.pt.





